วัคซีน ‘โควิด-19’ HXP–GPOVac ของ ‘องค์การเภสัชกรรม’ เริ่มวิจัยในมนุษย์ระยะ ที่ 2
วัคซีน ‘โควิด-19’ HXP–GPOVac ของ ‘องค์การเภสัชกรรม’ เริ่มวิจัยในมนุษย์ระยะ ที่ 2
วัคซีน “โควิด-19” HXP–GPOVac ของ “องค์การเภสัชกรรม” เริ่มวิจัยในมนุษย์ระยะที่ 2 หลังการศึกษาวิจัยในมนุษย์ระยะที่ 1 ประสบผลสำเร็จ คาดกลางปี 2565 เริ่มผลิตได้ เบื้องต้น 20-30 ล้านโดสต่อปี
นายแพทย์วิฑูรย์ ด่านวิบูลย์ ผู้อำนวยการองค์การเภสัชกรรม กล่าวว่า หลังจากที่องค์การเภสัชกรรมได้ดำเนินการวิจัยพัฒนากระบวนการผลิตวัคซีน และได้ทำการผลิตวัคซีนป้องกันโควิด HXP–GPOVac จนสำเร็จในขั้นแรก และนำเข้าสู่ขั้นตอนของการศึกษาวิจัยในมนุษย์ นับเป็นวัคซีนโควิดชนิดแรกของประเทศไทย ที่ได้วิจัยในมนุษย์ ซึ่งขณะนี้การศึกษาวิจัยในมนุษย์ในระยะที่ 1 ได้ผลการวิเคราะห์ภูมิคุ้มกันที่ 14 วัน หลังจากได้รับวัคซีนครบ 2 เข็มแล้ว

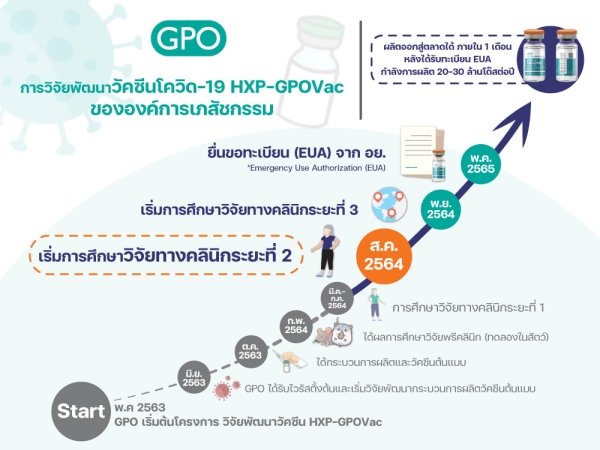

“ในวันนี้ (16 สิงหาคม 2564) องค์การฯได้เริ่มทำการศึกษาวิจัยในมนุษย์ระยะที่ 2 โดยวิจัยในอาสาสมัคร จำนวน 250 คน อายุ 18-75 ปี ที่มีสุขภาพดี ไม่เคยฉีดวัคซีนป้องกันโควิดทุกชนิดมาก่อน และไม่เคยเป็นผู้ป่วยโควิดมาก่อน”
นายแพทย์วิฑูรย์ กล่าวว่า การศึกษาวิจัยในมนุษย์ระยะที่ 1 และ 2 นี้ องค์การฯ ได้ให้คณะเวชศาสตร์เขตร้อน มหาวิทยาลัยมหิดล เป็นผู้ดำเนินการศึกษาวิจัย โดยมี ศ.พญ.พรรณี ปิติสุทธิธรรม หัวหน้าภาควิชาอายุรศาสตร์เขตร้อน รักษาการหัวหน้าศูนย์วัคซีน คณะเวชศาสตร์เขตร้อน มหาวิทยาลัยมหิดล เป็นหัวหน้าโครงการศึกษาวิจัยในมนุษย์ครั้งนี้
นายแพทย์วิฑูรย์ กล่าวด้วยว่า องค์การฯ ได้พัฒนาวัคซีน HXP–GPOVac โดยการสนับสนุนจากองค์กร PATH ที่ได้ส่งมอบหัวเชื้อวัคซีนต้นแบบ ซึ่งพัฒนาโดยโรงเรียนแพทย์ที่เมาท์ไซนาย (The Icahn School of Medicine at Mount Sinai) และมหาวิทยาลัยเท็กซัสที่ออสติน (University of Texas at Austin) ประเทศสหรัฐอเมริกา มาทำการผลิตที่โรงงานผลิต(วัคซีน)ชีววัตถุ ขององค์การฯ ที่ ต.ทับกวาง อ.แก่งคอย จ.สระบุรี
ทั้งนี้ ได้มีการวิจัยพัฒนากระบวนการผลิตและสามารถผลิตวัคซีน HXP–GPOVac จากนวัตกรรมเชื้อตายชนิดลูกผสม (Inactivated chimeric vaccine) ผลิตด้วยเทคโนโลยีไข่ไก่ฟัก (Egg-based) เช่นเดียวกับการผลิตวัคซีนไข้หวัดใหญ่ และนำเข้าสู่กระบวนการวิจัยในมนุษย์ได้สำเร็จในระยะเวลา 10 เดือน
“เมื่อการศึกษาวิจัยในมนุษย์ครบทั้ง 3 ระยะและได้รับการขึ้นทะเบียนตำรับ เพื่อใช้ในกรณีฉุกเฉิน (Emergency Use Authorization, EUA) จากสำนักงานคณะกรรมการอาหารและยา (อย.) สำเร็จ คาดว่า จะเริ่มผลิตได้ในกลางปี 2565 โดยจะสามารถผลิตได้ 20-30 ล้านโดสต่อปี และจะทำการขยายกำลังการผลิตอย่างต่อเนื่อง ในเบื้องต้นนี้ ‘วัคซีน HXP–GPOVac’ จะสามารถรองรับการฉีดเพื่อป้องกันโควิด-19 ให้ชาวไทยได้ 10-15 ล้านคน”

ด้าน ดร.ภญ.พรทิพย์ วิรัชวงศ์ หัวหน้าโครงการ “วัคซีน HXP–GPOVac” องค์การเภสัชกรรม กล่าวว่า หัวเชื้อวัคซีนต้นแบบนี้ ได้พัฒนาจากนวัตกรรมการตัดต่อไวรัสนิวคาสเซิล (Newcastle disease virus, NDV) ให้มีการแสดงออกของโปรตีนหนามของไวรัสโคโรนาที่ได้ถูกปรับแต่งด้วยเทคโนโลยีเฮกซะโปร (HexaPro) ให้มีความคงตัวมากขึ้น มาใช้ในการกระตุ้นร่างกายให้สร้างภูมิคุ้มกันต้านโรคโควิด-19
“เทคโนโลยีเฮกซะโปรนี้ ถูกพัฒนาที่มหาวิทยาลัยเท็กซัสที่ออสติน โดยนักวิจัยกลุ่มเดียวกับที่ได้พัฒนาโปรตีนหนามรุ่นแรกที่ใช้ในวัคซีนโควิด-19 อย่างน้อย 3 ชนิดที่มีการใช้อยู่ทั่วโลก โดยองค์กร PATH ได้ส่งมอบหัวเชื้อไวรัส ให้แก่ 3 ผู้ผลิตวัคซีนในประเทศเวียดนาม ประเทศบราซิล รวมทั้งองค์การเภสัชกรรมของประเทศไทยด้วย ‘วัคซีน HXP–GPOVac’ นับเป็นความมั่นคง ลดการนำเข้า และเป็นการพึ่งพาตนเองด้านวัคซีนของประเทศอย่างยั่งยืน และยังส่งผลต่อความมั่นใจในการดำเนินชีวิตและการขับเคลื่อนเศรษฐกิจของสังคมไทย” ดร.ภญ.พรทิพย์ กล่าว



//..................
CR : องค์การเภสัชกรรม
//..................









